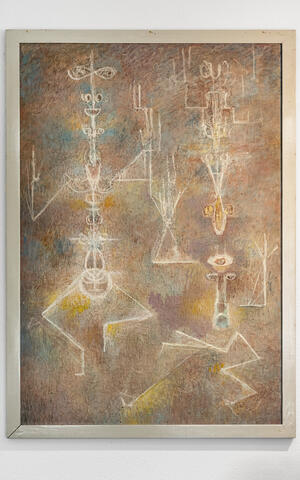Der Gen-Virtuose
Das war wieder so eine „gute“ Entdeckung. Eine Verfeinerung der revolutionären Genschere CRISPR/Cas9, mit der sich krankhafte Gene in der DNA ausschalten oder reparieren lassen. Dabei werden durch ein Enzym, Nickase genannt, die zwei Stränge der DNA nicht in einem Schnitt, sondern in bestimmtem Abstand versetzt geschnitten und damit Doppelstrangbrüche vermieden, die zu unerwünschten Reaktionen der Zelle führen können. Spacer Nick, so der griffige Name der verbesserten Genschere, verringert die Wahrscheinlichkeit einer Fehlreparatur am erwünschten Gen in drastischer Weise. Und auch Fehlschnitte an unerwünschten Stellen des Erbgutfadens treten damit kaum noch auf. Das könnte für künftige Gentherapien von Erbkrankheiten von Nutzen sein, die auf einem einzelnen defekten Gen beruhen, wie etwa sogenannte Bluterkrankheiten.
„Das ist gut“, sagt Professor Klaus Rajewsky und man weiß, wenn er „gut“ sagt, kann das mehr bedeuten. Vielleicht sogar „wegweisend“. Man kann ihm das als Bescheidenheit auslegen, aber es ist auch die Relativität, die ein langes Forscherleben mit sich bringt. „Wir finden es potenziell wichtig. Aber wissen Sie, die Technologie geht heute so schnell weiter“, sagt Rajewsky. Weißhaarig, eine Brille auf der Nase, eine zweite an einem Band um den Hals gehängt, sitzt er an einem Besprechungstisch in seinem Büro am Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin-Buch. Er streicht mit den Händen über das glänzende Furnier und erzählt von der Geschichte und Gegenwart der Genetik mit einer Ausdauer und Präzision, die eine tiefgründige Leidenschaft erahnen lassen.
Spacer Nick, die verbesserte Genschere, die er mit Dr. Van Trung Chu und Kolleg*innen aus seinem und anderen MDC-Teams im Sommer 2022 vorgestellt hat, ist nur eines von vielen Projekten, die er mit seinen 85 Jahren noch immer begleitet, mitdenkt, vorantreibt. „Ruhestand? Das ist witzig, dass Sie fragen, den hatte ich gar nicht“, entgegnet er, ohne dass sich ein Lächeln andeutet. „Wenn man spannende Sachen macht, besteht kein zwingender Grund aufzuhören.“
Eine berauschende Gegenwart, die anhält
Seit sechs Jahrzehnten spürt Klaus Rajewsky genetischen Mechanismen nach, die dem Immunsystem zugrunde liegen und Krankheiten entstehen lassen. Sechs Jahrzehnte, in denen immer wieder „Glückszufälle“ passierten, wie er es nennt. Diese berauschende Gegenwart hält bis heute an. Sein 15-köpfiges Team am MDC forscht zu genetischen Methoden und Grundlagen der B-Zell-Entwicklung, zu Tumoren und anderen Krankheiten, die aus B-Zellen entstehen können. Immer wieder kommen „gute“ Entdeckungen dabei heraus. So konnten sie 2019 zeigen, dass bei der Differenzierung von B-Zellen der angeborenen Immunität die Ausprägung eines autoreaktiven Antigenrezeptors die Schlüsselrolle spielt. Die Studie in „Science“ war eine Art „game changer“, wie er zugeben muss. Es ist einer von rund 230 Artikeln, die Klaus Rajewsky mitveröffentlicht hat seit er im Alter von 65 Jahren der Emeritierung entgangen ist.
Wenn der Altmeister der Immungenetik über die Vergangenheit spricht, dann schaut er kurz herunter auf den Tisch, als bräuchte es einen neutralen Hintergrund, um die unzähligen Momente, Zusammenhänge und Gesichter derjenigen hervorzurufen, die ihn geprägt haben. Die Nobelpreisträger François Jacob und Jacques Monod etwa, Max Delbrück oder Niels Jerne, beide ebenfalls Nobelpreisträger. Seine Forscherbiografie liest sich wie eine Chronik der modernen Immungenetik, deren Entwicklung er selbst begleitet und gestaltet hat.
Von Enzymen in die Welt der Antikörper
Alles begann mit Laktatdehydrogenasen. Das sind Enzyme, die in den menschlichen Zellen Stoffwechselvorgänge ermöglichen. Für seine Doktorarbeit am Institut für Chemie der Goethe-Universität Frankfurt am Main untersuchte er, wie Unterformen dieses Enzyms entstehen. „Das konnte ich nicht herausfinden, aber ich habe Antikörper hergestellt, mit denen ich die Unterformen analysiert habe“, sagt Rajewsky. Die Antikörper waren plötzlich viel interessanter als die Enzyme. Ihre Vielfältigkeit begeisterte ihn, wie sie zwischen selbst und fremd unterscheiden, wie sie ein „Gedächtnis“ ausbilden und lernen, mit der Zeit besser zu werden. Es blieb nur der Weg in die Immunologie.
Also beschließt er 1962, ans Pariser Institute Pasteur zu gehen, in das immunochemische Labor des Antikörperspezialisten Pierre Grabar, ein Freund seines Vaters, des Biophysikers Boris Rajewsky. „Ich traf in Paris auf eine völlig neue Internationalität, ganz anders als im Nachkriegsdeutschland“, erinnert er sich. Oft setzt sich der damals 26-Jährige mit offenen Augen und Ohren in ein Seminar im verrauchten und überfüllten Labor der späteren Nobelpreisträger Jacob und Monod. Elektrisiert verfolgt er die Debatten zu Genregulationsmechanismen in Bakterien, von denen er nur einen Bruchteil versteht. „Die Art, wie dort alle offen und leidenschaftlich miteinander diskutierten, hat mich zutiefst beeindruckt.“
Als Immunologe zwischen Molekularbiologen
Man musste nicht immer ‚Herr Professor‘ sagen. Alle liefen leger gekleidet herum und schwatzten miteinander. Das war wirklich befreiend.
Er kehrt nach Deutschland zurück – und wird 1964 Forschungsassistent an dem wenige Jahre zuvor von Max Delbrück gegründeten Institut für Genetik an der Universität zu Köln. „Ich zögerte keinen Moment, weil ich vermutete, dass dort eine ähnliche Atmosphäre herrscht wie bei Jacob und Monod“, sagt Rajewsky. Und tatsächlich: Delbrück hatte das Institut nach amerikanischem Vorbild aufgebaut, mit kleinen Gruppen und flachen Hierarchien. „Man musste nicht immer ‚Herr Professor‘ sagen. Alle liefen leger gekleidet herum und schwatzten miteinander. Das war wirklich befreiend.“
Der Institutsgründer kommt jedes Jahr für ein paar Monate nach Köln und hält seine Vorlesungen. Rajewsky besticht Delbrücks Rigorosität, seine Besessenheit, zur Wahrheit in der Forschung vorzudringen. „Ihm ging es nur um Evidenzen, nichts drum herum. Das habe ich auch immer versucht so zu halten“, sagt Rajewsky. Was er damals nicht ahnt: Er wird 38 Jahre an Delbrücks Institut bleiben, 31 davon als Professor für Molekulargenetik. Als er die Stadt am Rhein 2001 verlässt, ist seine Abteilung die größte von allen, mit zeitweise 76 Mitarbeiterinnen und Mitarbeitern, von denen viele bis heute die Immungenetik vorantreiben.
„Es war so eine Zeit, in der alle Türen aufgingen“
„Köln war für mich ein ungeheures Glück. Ich kam genau zur richtigen Zeit an den richtigen Ort. Damals entwickelte sich gerade die Molekularbiologie und ich war fast der einzige Immunologe dort“, sagt Rajewsky. Seine Antikörper-Expertise ist im Institut gefragt, hauptsächlich aber treibt er seine immunologische Forschung voran, gründet nach zwei Jahren eine Abteilung für Immunologie und stellt erfolgreich Anträge bei der Deutschen Forschungsgemeinschaft und anderswo. „Die Schnittstelle zwischen Molekularbiologie und Immunologie wurde immer größer“, sagt Rajewsky.
Menschen aus aller Welt kommen nach Köln, um Delbrücks berühmten Kurs zu Bakteriophagen zu durchlaufen, also zu Viren, die Bakterien befallen. „Die meisten, die später die Biochemie und andere Bereiche der Molekularbiologie in Deutschland prägten, waren damals in Köln“, sagt Rajewsky. Auch seine Abteilung – „our little universe“ nennt er sie gerne – wächst und wird internationaler. Junge Forscherinnen und Forscher kommen aus Japan, China, USA und Frankreich. „Wir waren eine tolle Gemeinschaft und hatten eine unwahrscheinlich produktive Diskussionskultur“, erinnert sich Rajewsky. „Es war eine Zeit, in der alle Türen aufgingen, jedes Experiment war etwas ganz Neues.“ Gemeinsam machen sie immungenetische Pionierarbeit an Mäusen, wollen Grundlegendes verstehen. Wie sich die antikörperbildenden B-Zellen aus Stammzellen entwickeln etwa, wie sie ihre Antikörper bilden, warum es verschiedene Antikörper-Klassen gibt und wie diese ihre Bindungsstärke gegenüber Erregern entwickeln, die sie bekämpfen sollen.
Entdeckung einer genetischen Standardtechnologie
Eine wichtige Tür öffnet sich 1991, als sie beweisen, dass B-Zellen ihre Antikörper in spezialisierten zellulären Kompartimenten trainieren, den Keimzentren. Rajewskys Team zeigt: Dort verbessern sie durch Mutation ihre Bindungsstellen, um Krankheitserreger gezielter abzuwehren. Bald darauf finden sie mittels molekularer Untersuchungen an Einzelzellen heraus, dass B-Zellen auch der Ursprung des bis dahin rätselhaften Hodgkin-Lymphoms sind, einer häufigen Form von Lymphdrüsenkrebs.
Die wohl wichtigste Tür öffnet sich aber 1994, als sein Team in Kollaboration mit J. Marth aus Vancouver die erste Maus züchtet, in der sich ein genomisches Gen beschränkt auf einen einzelnen Zelltyp ausschalten lässt. Vorher war es nur möglich, mit „Knock-out-Mäusen“ Gene in der Keimbahn auszuschalten und damit in allen Zellen auf einmal, was unvorhersehbare Folgen haben, auch tödlich sein kann. Die resultierende Publikation löst eine Revolution aus. Die konditionale Mutagenese setzen heute tausende Labore weltweit als genetische Standardtechnologie ein und sie wird stetig weiterentwickelt, um die Rolle von Genen im normalen Organismus und bei der Entstehung von Krankheiten zu ergründen. „Plötzlich kamen aus der ganzen Welt Leute zu uns ins Labor, die das lernen wollten“, sagt Rajewsky. Sein Team nutzt die Technologie unter anderem, um wesentlich effektiver als vorher Tumormodelle in Mäusen zu erstellen und zu verstehen, was den Krebs antreibt.
Neuanfang in Harvard mit 65 Jahren
Rajewsky greift nie nach dem Amt eines Dekans, Rektors oder Forschungsdirektors. Er will bei der Sache bleiben, sich nicht zerreiben lassen. „Ich habe mich auch immer dagegen gesträubt, dass mein Tag vollkommen verplant wird und ich in so eine Maschinerie hineingezogen werde; ich brauche Rückzugszeiten, um zu denken und abzuschalten“, sagt er.
Als sein Ruhestand naht, wird er unruhig. „Mein Vater konnte seine Emeritierung nur wenige Jahre herauszögern“, erinnert sich Rajewsky. „Dieser Pein wollte ich unbedingt entgehen, ich machte doch weiter produktiv Forschung.“ In Köln bietet man ihm zwei weitere Jahre an. Rajewsky verabschiedet sich schon vorher teilweise nach Rom, baut dort das Mausprogramm des Europäischen Laboratoriums für Molekularbiologie (EMBL) auf und erhält wenig später ein Angebot, das er nicht ausschlagen kann: von der Harvard Medical School in Boston. Mit 65 Jahren wagt er einen Neuanfang, viele seiner engsten Mitarbeiter folgen ihm. Noch einmal investiert er all seine Energie in die Erforschung von B-Zellen und von Tumoren des lymphatischen Systems sowie der Rolle der neu entdeckten mikroRNAs bei der Zellentwicklung. „Es waren tolle Jahre“, erinnert er sich.
Wieder eine Zeit des Umbruchs – wieder mittendrin
Bild der Berliner Künstlerin Jeanne Mammen
Klaus Rajewsky ist 75, als ihm das Max-Delbrück-Centrum anbietet, in Berlin weiter zu forschen, abhängig von Begutachtungen, aber ohne Altersbegrenzung. „Ich kam also nicht als Emeritus hierher“, sagt er und lacht kurz, wie er es immer tut, wenn ihm rückblickend klar wird, was für ein „Glückszufall“ das war. In seinem Berliner Büro hängt er ein Bild auf, das ihn über Jahrzehnte in Köln begleitet hat. Max Delbrück hatte es in den 1960-er Jahren von einer Freundin, der Berliner Künstlerin Jeanne Mammen, gekauft. Es zeigt zwei von afrikanischer Kunst inspirierte Figuren.
Es ist 2012 und wieder so eine „Zeit des Umbruchs“, wie damals in Köln, als die Molekularbiologie zu ihrer Blüte kam. Jetzt stellen computerbasierte Methoden, Big Data und künstliche Intelligenz die Lebenswissenschaften auf den Kopf. Sein Sohn Nikolaus Rajewsky ist vorne dabei, hat das Berliner Institut für Medizinische Systembiologie (BIMSB) des MDC gegründet. „Da tut sich eine faszinierende neue Welt auf, weil man große Datensätze kombinieren und Informationen herausdestillieren kann, von denen man früher nur träumen konnte“, sagt Rajewsky. „Heute schaut man sich oft nicht mehr ein einzelnes Gen an, sondern genomweite Expressionsmuster von Genen und ihre Beziehungen untereinander, in Zellverbänden und Einzelzellen.“
Kurz nach seiner Ankunft am MDC liest Rajewsky ein Paper im Fachjournal „Nature“, das die Genetik erneut verändern sollte: Die Genschere CRISPR/Cas9 war geboren. „Das war ein dramatischer Fortschritt. Wir haben sofort angefangen, damit zu arbeiten“, sagt Rajewsky. Seine konditionale Mutagenese ist plötzlich viel einfacher nutzbar, weil die benötigten Mutationen jetzt direkt ins Erbgut von Mäusen eingefügt werden können, statt den Umweg über embryonale Stammzellen zu gehen.
Grundlagen für neue Gentherapien
Wieder ist Klaus Rajewsky mittendrin. Sein Team, oft in Kooperation mit anderen, auch klinisch orientierten Arbeitsgruppen, nutzt jetzt computergestützte Methoden und CRISPR/Cas, um die genetischen Ursprünge von Krankheiten zu verstehen – wie Infektionen mit dem Epstein-Barr-Virus, welches antikörperbildende B-Zellen befällt, zu Multipler Sklerose führen können zum Beispiel. Mausmodelle liefern weiter therapeutische Ansatzpunkte – zum multiplen Myelom etwa, einer bösartigen Erkrankung des Knochenmarks, oder zum Burkitt-Lymphom, einem aggressiven Lymphdrüsenkrebs.
„Wir studieren manches jetzt auch in menschlichen Zellen und hoffen, Grundlagen für neue Gentherapien liefern zu können“, sagt Rajewsky. Doch sein Fokus sind nach wie vor die Grundlagen. Es gibt noch viele Kapitel aufzuschlagen. Aufhören? Warum?
„Es macht mir Spaß, Neues anzugehen“, sagt er. Und macht weiter.
Text: Mirco Lomoth
Weiterführende Informationen
- Feinschliff für die Genschere
- Entscheidung über Leben und Tod
- Der Ursprung der B1-Zellen
- Immunologie und Inflammation
- Das „kleine Universum“ als vorbildliches Labor (Interview mit Klaus Rajewsky)
- Years in Cologne (Rückblick von Klaus Rajewsky)