📺 Der lange Atem gegen Krebs: Von der Grundlagenforschung zur Therapie

Der lange Atem – ein Film mit Thomas Blankenstein, Elisa Kieback, Mathias Leisegang, Antonio Pezzutto und Wolfgang Uckert
In den letzten zwei Jahren sind zwei Medikamente auf den Markt gekommen, die sich auf Grundlagenforschung am MDC stützen und die völlig neue Wirkprinzipien nutzen: Blincyto, eine Immuntherapie gegen Krebs, und Vonvendi, ein Mittel gegen eine erbliche Blutgerinnungsstörung. Auf diese Erfolge ist das MDC stolz, schließlich ist die translationale Forschung ein Teil des Gründungsauftrags. Die Ergebnisse aus dem Labor sollen Patientinnen und Patienten zugutekommen.
Das klingt einfach und ist doch besonders schwer umzusetzen. Denn man braucht dafür nicht nur gute Leute, gute Technik und gute Ideen, sondern auch einen sehr langen Atem. Wenn alles gut läuft, dauert der Weg von der Grundlagenforschung im Labor bis zum Medikament etwa 15 Jahre. In unserem Film zeigen wir das am Beispiel einer vielversprechenden Krebsimmuntherapie.
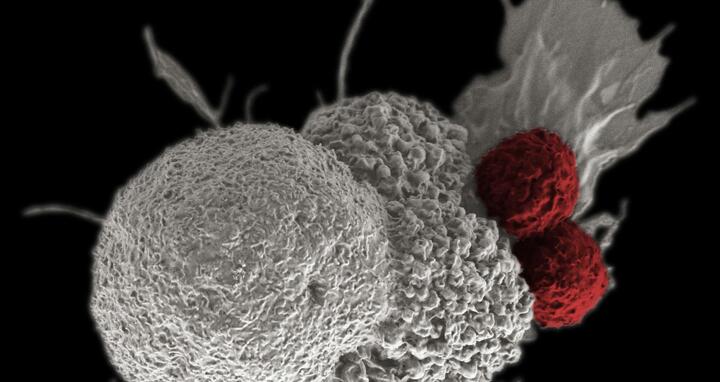
Manche Mutationen in der Krebszelle – und sei es ein einziger Buchstabe, der im Erbgut durch einen anderen ersetzt wird – führen dazu, dass das Immunsystem die Zelle als fremd einstufen kann. Zumindest, wenn dadurch der „Personalausweis“ auf der Oberfläche der Zelle ein neues Eiweiß präsentiert. Es ist wie ein manipuliertes Foto. T-Zellen, die als Polizeistreife den Körper nach Eindringlingen absuchen, können es entlarven, an dieser Stelle andocken und die Tumorzelle zerstören.
Normalerweise schützt sich der Körper so vor Virusinfektionen. Bei Krebs versagt jedoch das Immunsystem, die T-Zellen nehmen das bearbeitete Foto nicht mehr wahr. Unter anderem die MDC-Forschungsgruppen um Professor Thomas Blankenstein und Professor Wolfgang Uckert wollen die T-Zellen so trainieren, dass sie das Foto wieder bemerken. Dafür erzeugten sie menschliche T-Zell-Rezeptoren zunächst in einer speziell dafür entwickelten Maus. Ab 2018 sollen nun die ersten Patienten in einer klinischen Phase I-Studie mit dieser Therapie behandelt werden.
Die Vorarbeiten begannen vor fast zwanzig Jahren. „Der erste Laborbucheintrag von meinem Kollegen Liang-Ping Li stammt aus dem Mai 2000“, erinnert sich Thomas Blankenstein. „Die erste Publikation zu dieser Maus erschien dann 2010.“ Liang-Ping Li ist inzwischen Professor in Guangzhou in China, doch lange Zeit war unklar, ob seine Versuche je zu etwas führen würden.
„So ist das mit Experimenten, das passiert jedem“, sagt Thomas Blankenstein. Ein Problem sei das vor allem für jüngere Forscherinnen und Forscher, die an der Laborbank die eigentliche Arbeit machen. Für sie hängt oft der nächste Karriereschritt vom Erfolg des Experiments ab. „Das ist zum Teil sehr belastend, wenn die Ergebnisse und eben auch die Publikationen ausbleiben.“ Auch für einen etablierten Gruppenleiter sind solche Durststrecken nicht einfach. „Ich hatte schon zwischendurch Zweifel, ob es funktionieren würde“, sagt Blankenstein.
Diese Ungewissheit, das Risiko des Scheiterns gehört in den Laboren zum Alltag – das ist ebenfalls ein Thema unseres Films. Diese Aussage betrifft nicht nur translationale Projekte. Wer an den Grenzen des Wissens forscht und neues Terrain erschließt, stößt fast immer auf unerwartete Hindernisse. Gleichzeitig ergeben sich Anwendungen, die zuvor niemand geplant hatte. Die Frage „Wofür ist das denn gut?“ kann man oft erst viel später beantworten.
Beispiele gibt es zuhauf. Michael Faraday wollte das Universum verstehen, als er elektromagnetische Induktion in seinen Experimenten nachwies. Wie die Elektrizität unser Leben verändern würde, welcher Nutzen sich daraus ergeben hat, konnte sich damals noch keiner vorstellen. Auch die Erforschung eines seltsamen Viren-Abwehrsystems von Bakterien war zunächst nur etwas für eine kleine Gruppe Mikrobiologen. Heute ist die Gen-Schere Crispr-Cas9 aus vielen Laboren – auch am MDC – nicht mehr wegzudenken. Hier offenbart sich die Kreativität der Grundlagenforschung.
„Viele Experimente (...) bewegen Generationen von Forschern, aber nicht die Welt“, schreibt der Wissenschaftstheoretiker Jürgen Mittelstraß. Trotzdem sei das keine nutzlose Wolkenschieberei. „Was auf den ersten Blick so erscheinen mag, gehört tatsächlich zum Wesen der Wissenschaft (...), macht ihre Neugierde und ihre Freiheit aus, ohne die sie nicht zu existieren vermag.“ Nur die Grundlagenforschung bringe das wirklich Neue in die Welt, nicht das Gewohnte oder das Begehrte.
Zuerst kommt die Entdeckung und mit ihr ein neues Verständnis, neue Fragen. Je grundlegender die Erkenntnis ist, desto mehr Fragen wirft sie auf. Desto mehr ahnen wir, was wir alles noch nicht wissen – ähnlich den ringförmigen Wellen, die ein Stein erzeugt, wenn er ins Wasser fällt. Das beflügelt die Neugier, ohne dass Grundlagenforschung gleich einen konkreten Nutzen versprechen muss. Sie ist auch so wertvoll.
Gleichzeitig lässt sich Grundlagenforschung nicht von der Anwendung trennen. Sie ist die Basis, auf der jedes translationale Projekt ruht – auch am MDC, das mittlerweile zu den weltweit führenden Forschungszentren der Biomedizin gehört. 1660 Menschen arbeiten am MDC daran, die molekularen Grundlagen von Gesundheit und Krankheit zu verstehen. Von Ionenkanälen über die T-Zell-Rezeptoren bis hin zur Regulation des Genoms. Manchmal ist das mühsam und langwierig. Für die Wissenschaftlerinnen und Wissenschaftler selbst, für die Institution, für die Geldgeber und Gesellschaft. Das muss man aushalten können.
„Gute Forschung ist für uns auch kreative und ergebnisoffene Forschung“, sagt Professor Martin Lohse, der Wissenschaftliche Vorstand. „Am MDC soll man auf Entdeckungen zulaufen können, die sich am Horizont abzeichnen, auch wenn das Ziel vielleicht noch unscharf ist und der Weg holprig und kurvenreich.“
Text von: Kerstin Hoppenhaus
Kerstin Hoppenhaus ist Wissenschaftsjournalistin und Regisseurin. Die Filme zum MDC-Jubiläum hat sie gemeinsam mit der Produzentin und Kamerafrau Sibylle Grunze realisiert.
Die Wissenschaft dahinter
KLINISCHE PHASE I STUDIE
Patienten mit Multiplem Myleom, denen die Standardtherapie nicht hilft, können ab Anfang 2018 an einer klinischen Phase I Studie in der Hämatologischen Klinik der Charité Campus Benjamin Franklin teilnehmen. Die gemeinsame Studie von Charité und MDC leitet Professor Antonio Pezzutto. Die Patienten erhalten autologe T-Zellen, die genetisch mit einem Rezeptor verändert sind, der ein spezifisches Antigen auf den Tumorzellen erkennt. Die Zellen werden im Reinraum des GMPLabors des ECRC auf dem Campus Buch hergestellt. Das Bundesministerium für Bildung und Forschung fördert die Studie im Programm Personalisierte Medizin mit 4,1 Millionen Euro.
T-KNIFE
T-knife ist eine Ausgründung des MDC, die T-Zelltherapeutika für die klinische Anwendung entwickelt. Die Firma hat umfangreiche Lizenzrechte vom MDC erworben, unter anderem eine Technologieplattform zur Generierung von krebsspezifischen Rezeptoren, diversen Rezeptoren und die Rechte an der klinischen Phase I Studie.
CAPTAIN T CELL
Ein Start-up-Projekt von MDC-Forschenden hat im Mai 2016 mit dem Projekt „Captain T Cell“ den OneStart-Wettbewerb in London gewonnen. OneStart ist der weltgrößte Wettbewerb für Start-ups in den Gesundheits- und Lebenswissenschaften. Dr. Felix Lorenz, Dr. Elisa Kieback, Julian Clauß und Dr. Inan Edes haben sich gegen 400 internationale Teams durchgesetzt. Das Preisgeld betrug 100.000 britische Pfund.
HELMHOLTZ INNOVATION LAB
Im Frühjahr 2017 startete das von der Helmholtz-Gemeinschaft geförderte „Max Delbrück Center Cell Engineering Lab“ (MDCELL). Bei dieser Plattform für anwendungsorientierte Forschung arbeiten Wissenschaft und Industrie eng zusammen. MD-CELL geht auf die Forschungsgruppen von Dr. Zsuzsanna Izsvák und Professor Wolfgang Uckert zurück. Sie entwickeln Verfahren, die Immunzellen sicher, reproduzierbar und in großer Menge mit neuen Genen ausstatten. Damit werden die T-Zellen auf den Tumor des Erkrankten „trainiert“.
HELMHOLTZ-VALIDIERUNGSFOND
Unter den aktuellen Förderprojekten des Helmholtz-Validierungsfonds ist eines von Dr. Armin Rehm und Dr. Uta Höpken. Sie wollen ein Gen-Therapeutikum für die bislang unheilbare Blutkrebserkrankung Multiples Myelom sowie für reifzellige B-Zell Non-Hodgkin-Lymphome entwickeln und verwenden dafür die CAR-T-Zell-Therapie.
SCHLÜSSELPUBLIKATIONEN / KEY PUBLICATIONS
Liang-Ping Li, J. Christoph Lampert, Xiaojing Chen, Catarina Leitao, Jelena Popović, Werner Müller, Thomas Blankenstein (2010). Transgenic mice with a diverse human T-cell antigen receptor repertoire. Nature Medicine. doi:10.1038/nm.219.
Matthias Obenaus, Catarina Leitão, Matthias Leisegang, Xiaojing Chen, Ioannis Gavvovidis, Pierre van der Bruggen, Wolfgang Uckert, Dolores J Schendel, Thomas Blankenstein (2015). Identification of human T-cell receptors with optimal affinity to cancer antigens using antigen-negative humanized mice. Nature Biotechnology. doi:10.1038/nbt.3147.
Matthias Leisegang, Thomas Kammertoens, Wolfgang Uckert, Thomas Blankenstein (2016). Targeting human melanoma neoantigens by T cell receptor gene therapy. Journal of Clinical Investigation. doi:10.1172/JCI83465.
Die elektronenmikroskopische Aufnahme zeigt T-Zellen (rot gefärbt) beim Angriff auf eine Krebszelle.