Mini-Organ, mathematisches Modell oder Maus?
Mini-Organe, die in der Petrischale wachsen. Algorithmen, die Unmengen Sequenzierdaten durchforsten und sogar Voraussagen machen. „Organs on a chip.“ Die Biomedizin ist längst nicht mehr nur auf Tierversuche angewiesen. Doch kann man deshalb auf sie verzichten?
Jana Wolf dämpft diese Hoffnung: „Von Newtons Beschreibung der Gravitationsgesetze bis zur Entwicklung der ersten Flugsimulatoren dauerte es mehr als 200 Jahre und es waren viele experimentelle Überprüfungen nötig. In der Biologie haben wir bisher nicht einmal alle grundlegenden Gesetze entschlüsselt.“
In der Biologie haben wir bisher nicht einmal alle grundlegenden Gesetze entschlüsselt.
Die Biophysikerin entwickelt Modelle für normale oder krankhaft veränderte Prozesse in Zellen. Nur wenn die Grundannahmen stimmen, können ihre Modelle wirklich gut werden. Und auch was der Computer über die belebte Natur errechnet, müssen andere in Experimenten überprüfen. Oft geht das nur mit Tierversuchen. Im Dezember 2020 hat die Professorin deshalb – wie ungefähr 40 Wissenschaftlerinnen und Wissenschaftler am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) – Position bezogen und erklärt, warum tierversuchsfreie Methoden aus ihrer Sicht keine Alternative sind, sondern das Bild vervollständigen.
Grundsätzlich gilt: Wer als Forscherin oder Forscher Experimente mit Mäusen, Ratten oder anderen Tieren plant, muss zuvor nachweisen, dass es nicht anders geht. „Alle Optionen müssen ausgeschöpft sein, das ist gesetzlich vorgeschrieben“, sagt die Tierschutzbeauftragte und Tierhausleiterin Nadja Daberkow-Nitsche vom MDC. Die Zahl der Experimente mit Tieren soll möglichst klein und das Leid so gering wie möglich bleiben.
Etwa ein Drittel der MDC-Forschungsgruppen arbeitet komplett ohne Tierversuche – so wie Jana Wolf. Die meisten der mehr als 70 Arbeitsgruppen machen beides: Um zu verstehen, welche Prozesse bei Gesundheit und Krankheit ablaufen, nutzen sie sowohl tierversuchsfreie Methoden als auch Experimente mit Tieren.
- Was bedeutet in vivo, in vitro, in silico?
-
Organismus, Petrischale und Computer
-
In vivo erforschen Wissenschaftler*innen Prozesse innerhalb eines lebenden Organismus, dagegen stellen sie mit in-vitro-Methoden natürliche Prozesse in einer künstlichen Umgebung nach – etwa im Reagenzglas oder in der Petrischale.
Physiologische Abläufe können Forscher*innen auch in silico, also am Computer, modellieren und untersuchen. Solche mathematischen Modelle beruhen auf Daten aus den Laboren.
Zellen außerhalb eines Organismus kultivieren
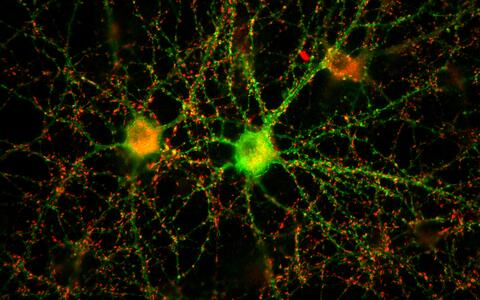
Ein neuronales Netzwerk aus zwei Nervenzellen in der Petrischale
Zellkulturen sind Standard in der Wissenschaft. Innerhalb der künstlichen Umgebung der Petrischale oder des Reagenzglases ist die Situation weniger komplex als in vivo. Die Untersuchungsbedingungen lassen sich besser kontrollieren und in Folgeexperimenten reproduzieren.
Dabei sind primäre Zellen jenen im lebenden Körper am nächsten. Sie stammen direkt aus dem Blut oder Gewebe von Spender*innen und Patient*innen. Primäre Zellen altern und sterben schnell ab, sie lassen sich nur wenige Tage in Kultur halten. Und manchmal sind Biopsien nur schwer oder gar nicht zu bekommen, zum Beispiel aus der Lunge oder dem Gehirn.
Weltweit arbeiten Wissenschaftler*innen auch mit unsterblichen Zelllinien, die ihren Ursprung in Tumorzellen haben oder im Labor so verändert wurden, dass sie sich unbegrenzt teilen können.
- Primäre Zellkulturen: Beispiele aus der Forschung
-
Den Zellen im im lebenden Körper am nächsten
-
Primärkulturen können beispielsweise viel darüber verraten, wie Krankheiten oder Allergien entstehen. Die MDC-Arbeitsgruppe von Professorin Young-Ae Lee stimuliert im Labor primäre Immunzellen aus dem Blut allergischer Kinder. Sie will wissen, wie die Zellen darauf reagieren. Mithilfe der Einzelzellanalyse kann ihr Team außerdem verschiedene Subtypen von Immunzellen in den Patient*innenproben charakterisieren, die mehr über die Immunreaktion als Ganzes preisgeben. Auch viele mathematische Modelle beruhen auf Sequenzierdaten von Primärkulturen.
- Transformierte Zellen: Funktionelle Studien mit HeLa
-
Unsterbliche Zelllinien
-
Weltweit arbeiten Wissenschaftler*innen mit unsterblichen Zelllinien. Die robusten Zellen eignen sich für funktionelle Studien wie Untersuchungen zum Zellzyklus oder dem zellulären Stoffwechsel. Außerdem können sie genetisch viel leichter verändert werden als eine primäre Zelle oder gar ein Lebewesen; sie sind kostengünstig und ständig verfügbar. Forschende bestellen sie bei einer Zelldatenbank im Internet. „Wir erforschen grundlegende molekulare Prozesse, die teilweise sogar in Hefezellen sehr ähnlich ablaufen wie in menschlichen Zellen. Dafür brauchen wir vor allem eine große Anzahl Zellen, die sich gut manipulieren lassen. Der Zelltyp an sich ist dabei nicht so wichtig“, sagt Dr. Emanuel Wyler, der am Berliner Institut für Medizinische Systembiologie (BIMSB) des MDC die Regulation von Genen unter anderem mit HeLa Zellen erforscht.
Die Abkürzung HeLa steht für Henrietta Lacks. Die US-Amerikanerin erkrankte in den 1950er Jahren an einem aggressiven Zervix-Karzinom. Ihre Ärzt*innen haben aus einer Probe mit ihren Tumorzellen die erste humane unsterbliche Zelllinie kultiviert. Bis heute werden HeLa-Zellen überall auf der Welt für die medizinische und grundlegende Forschung eingesetzt.
Die Transformation in eine unsterbliche Zelle geht aber auf Kosten einiger ihrer ursprünglichen Eigenschaften: Solche Dauerkulturen haben einen veränderten Zellstoffwechsel, können sich manchmal nicht mehr aneinanderheften, Herzzellen schlagen nicht mehr und Zelltypen sehen komplett anders aus als im Zellverband des Ursprungsorgans.
Stammzellen aus dem Labor
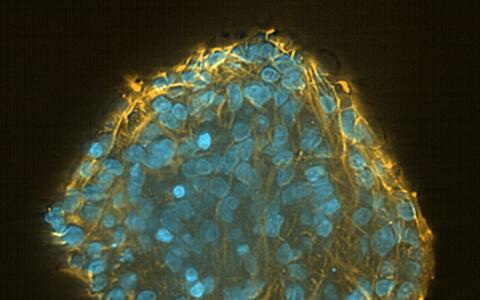
Induzierte pluripotente Stammzellen in einem Pluripotenztest
Deshalb greifen viele Forschende auf induzierte pluripotente Stammzellen (iPS-Zellen) zurück. Die Alleskönner sehen unspektakulär aus, fast wie gewöhnliche Zellen. Mit einem großen Zellkern, umgeben von Zytoplasma, drängen sie sich dicht an dicht zu kleinen Inseln auf dem Boden der Petrischale zusammen. Wer einen Blick durch eines der Mikroskope wirft, die im Labor der MDC-Technologie-Plattform von Dr. Sebastian Diecke stehen, kann die Talente der iPS-Zellen kaum erahnen.
Theoretisch können sie sich in jeden beliebigen Zelltyp des menschlichen Körpers verwandeln. Im Gegensatz zu primären Stammzellen, etwa aus dem Muskel, sind sie in Zellkultur unsterblich. Und anders als embryonale Stammzellen lösen sie keine ethischen Kontroversen aus. „Viele hoffen, dass sie irgendwann einmal Tierversuche ersetzen können“, sagt Diecke.
Seinem Team reichen einfache Haut- oder Blutzellen, um Stammzellen herzustellen. Mithilfe eines Cocktails mit vier genetischen Faktoren programmieren sie normale Zellen in pluripotente Stammzellen um. Jetzt kann daraus ein gewebespezifischer Zelltyp entstehen – zum Beispiel ein Neuron oder eine Herzmuskelzelle.
Stammzellen in der Herzforschung
Die Arbeitsgruppe von Professor Norbert Hübner arbeitet mit solchen künstlich erzeugten Herzmuskelzellen, die ähnliche Eigenschaften wie echte Zellen haben und im Sinne der 3R (Replace, Reduce, Refine – Vermeiden, Verringern, Verbessern) nicht aus Maus- oder Rattenherzen isoliert werden. „Allerdings erreichen sie nicht das Niveau, das sie im adulten Herzen haben würden. Sie sind unreif und ähneln eher Zellen des fetalen Status“, sagt Dr. Henrike Maatz. Zellen, die über Monate im Brutschrank kultiviert werden, sind außerdem sehr aufwendig und teuer. „Wir müssen sie täglich versorgen.“
Patient*innenspezifische iPS-Zellen haben die gleiche genetische Ausstattung wie ihre Spender*innen. Sie bilden die Krankheit auf molekularer Ebene ab und werden deshalb gerne für erste Medikamententests eingesetzt. Zuvor sind jedoch Vorversuche nötig.
Stammzellen in der Alzheimerforschung
In der Zellkultur hat Alzheimer-Forscher Professor Thomas Willnow zum Beispiel zunächst untersucht, was die Erbanlage ApoE4, ein Protein oder Eiweiß, auf molekularer Ebene in den Nerven bewirkt und warum sie das Demenzrisiko mehrfach erhöht. So entdeckte Willnow einen krankheitsauslösenden Prozess – einen Defekt im Fettstoffwechsel der Nervenzellen. Diese Ergebnisse musste sein Team im Mausmodell überprüfen, um Wechselwirkungen mit Stoffwechselprozessen in Leber oder Darm im lebenden Organismus auszuschließen. Erst seitdem steht fest: Alle anschließenden Untersuchungen sind mit menschlichen Nervenzellen aus iPS-Kulturen möglich. Sein Team möchte nun Substanzen finden, die den veränderten Stoffwechselvorgang in der Zelle wieder in die richtige Bahn lenken.
Nach Medikamententests in der Zellkultur müssen Wissenschaftler*innen die Wirksamkeit und Sicherheit der Substanz noch einmal in Tierversuchen bestätigen. Erst dann kann eine klinische Studie mit Menschen beginnen. „Wir können in vitro zwar sehen, ob ein potenzielles Therapeutikum gegen Alzheimer den Krankheitsverlauf in einzelnen Zellen oder Zellverbänden verändert – der Einfluss auf die Gedächtnisleistung ist jedoch nur in Verhaltensstudien mit Tieren sichtbar“, erklärt Willnow.

Prof. Thomas Willnow und Dr. Anna Löwa sprechen über die Ursachen von Alzheimer und über Experimente mit Mäusen und Gehirnorganoiden.
Stammzellen in der Immunforschung
In-vitro-Methoden kommen in der Biomedizin auch dann an ihre Grenzen, wenn es mehrere mögliche Faktoren gibt, die das Risiko einer Krankheit erhöhen. Dr. Alexander Mildner zum Beispiel erforscht die Autoimmunkrankheit Multiple Sklerose (MS), die bei jedem oder jeder Patient*in auf unterschiedliche Art und Weise entstehen kann. Er will wissen, wie Immunzellen bei MS-Patient*innen die Blut-Hirn-Schranke überwinden und im zentralen Nervensystem Schaden anrichten können.
Diese Barriere schützt normalerweise das zentrale Nervensystem vor Zellen, die dort nichts zu suchen haben. „Die Blut-Hirn-Schranke oder auch das Nervensystem besteht aus einer Vielzahl von unterschiedlichen Zelltypen, die in ständigem Austausch stehen und nur im Kontext miteinander funktionieren“, sagt Mildner. Diesen Zellverbund in vitro zu einem komplexen dreidimensionalen Gewebe zusammenzusetzen, ist bisher technisch unmöglich. Außerdem lassen sich noch nicht alle Zelltypen des menschlichen Körpers aus iPS-Zellen herstellen. Bei Immunzellen beispielsweise ist der Differenzierungsprozess während einer Erkrankung nicht gut genug erforscht.
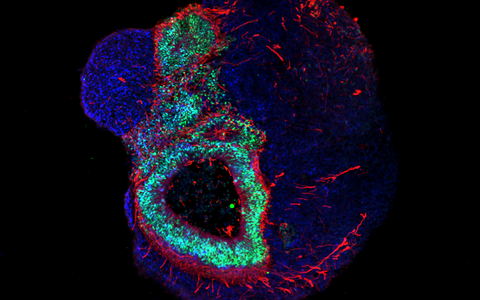
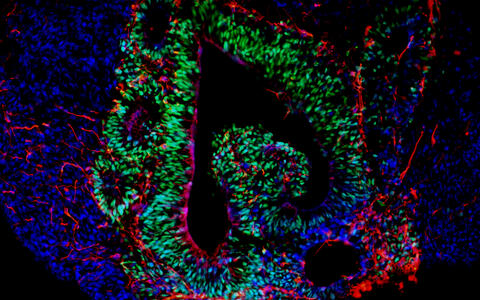
Organoide – „Mini-Organe“ aus der Petrischale
Organoide spiegeln das Zusammenspiel von mehreren Zelltypen wider. Die „Mini-Organe“ werden im Labor aus iPS-Zellen entwickelt, die sich durch künstlich erzeugte Signale, spontan zu dreidimensionalen organähnlichen Strukturen organisieren, die aus mehreren Zelltypen gleichzeitig bestehen.
Sie sind nur wenige Millimeter klein, doch sie bringen die Biomedizin einen großen Schritt vorwärts. „Kein anderes In-vitro-Zellkulturmodell liefert so komplexe Daten zu Zellfunktionen im menschlichen Körper“, sagt Dr. Agnieszka Rybak-Wolf. Die Leiterin der Organoid-Plattform am MDC erzeugt gemeinsam mit Diecke hauptsächlich Gehirn-Organoide. Aber auch Organe wie Lunge, Leber oder Darm können so imitiert werden. Und ein Team um Dr. Mina Gouti brachte ein neuromuskuläres Organoid aus Neuronen und Muskelzellen sogar zum Kontrahieren.

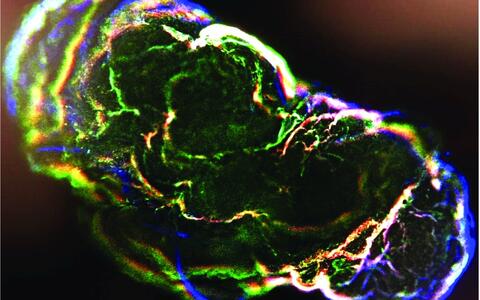
- Assembloids
-
Wenn mehrere Gehirnorganoide zusammengesetzt werden
-
Setzt man mehrere Organoide zusammen, die verschiedene Regionen im Gehirn nachbilden, heißen sie Assembloids. Sie bilden neuronale Schaltkreise zwischen Zellen einzelner Gehirnregionen nach. Das Zusammenspiel aus Neuronen, Vorläuferzellen, Oligodendrozyten und Astrozyten könnte Hinweise geben, was im Gehirn eines kranken Menschen anders abläuft – wenn auch im Entwicklungsstadium eines Embryonen.
Dr. Silke Frahm-Barske aus Dieckes Team sieht Organoide als eine Ergänzung zum Tiermodell: Sie hat bei Mäusen beobachtet, dass Stress ein Protein beeinflusst, das bei Parkinson-Patient*innen im Übermaß vorkommt. Den gleichen Effekt zeigte sie anschließend bei Organoiden, die aus Zellen eines Patienten hervorgegangen sind. Ihre Annahme, dass Stress bei Parkinson eine große Rolle spielt, ist also auf den Menschen übertragbar.
Professor Erich Wanker, der unter anderem die Erbkrankheit Chorea Huntington erforscht, nutzt derzeit trotzdem lieber ein anderes Modell für genetische Studien: „Bei Fliegen können wir sehr präzise ins Erbgut eingreifen und die Ergebnisse sind besser reproduzierbar“, erklärt er.
Selbst eine Chemikalie eines anderen Herstellers kann große Effekte haben.
Bei Organoiden gleiche dagegen keines dem anderen. Das liege einerseits an unterschiedlichen genetischen Bedingungen im Ausgangsmaterial – den individuellen Zellen der Patient*innen. Andererseits gebe es bei der Herstellung von Organoiden viele Faktoren, die entweder nicht kontrollierbar oder sehr anfällig für kleinste Veränderungen seien. „Selbst eine Chemikalie eines anderen Herstellers kann große Effekte haben“, sagt Wanker.
Bislang ist es auch nicht möglich, Organoide mit eigenem Blutkreislauf zu erzeugen. Die organartigen Strukturen sind also auf Nährstoffe angewiesen, die Forschende ihnen von außen geben. Werden sie zu groß, bildet sich ein nekrotischer Kern: Ein Teil des Organoids bleibt unterversorgt und stirbt ab.
- Ein neues Einstein-Zentrum in Berlin
-
Berliner Netzwerk für die Entwicklung von alternativen Methoden zum Tierversuch in der biomedizinischen Forschung
-
Im Jahr 2021 entsteht als Kooperation von mehreren Berliner Forschungseinrichtungen, darunter auch das MDC, das „Einstein-Zentrum 3R“. In diesem Netzwerk sollen unter anderem 3D-Gewebemodelle sowie die Übertragbarkeit von Laborerkenntnissen auf die Patient*innen verbessert und gleichzeitig der Tierschutz gestärkt werden. Nachwuchswissenschaftler*innen sollen im geplanten Zentrum durch Ausbildung, Schulung und Weiterbildung in die Lage versetzt werden, das 3R-Prinzip stringent anzuwenden. Mit Einzelzellanalyse wollen MDC-Forschende Methoden mit Organoiden und Stammzelltechnologien voranbringen. Außerdem beteiligt sich das MDC an der Modellierung von Krankheiten wie Alzheimer, dem Leigh-Syndrom, Glioblastomen oder Infektionskrankheiten. Ziel ist, personalisierte Gentherapien für Patient*innen zu entwickeln.
Modellrechnungen der Wirklichkeit am Computer
Nicht alle Molekularbiolog*innen experimentieren im Labor mit Pipetten, Mikroskopen und anderen Geräten. Einige programmieren, füttern Modelle mit Daten, entwickeln Algorithmen. Prozesse im lebenden Körper können sie virtuell simulieren und so zelluläre Signalwege bei gesunden und kranken Menschen kartographieren. Zu welchem Zeitpunkt werden welche Gene angeschaltet und wann gerät die Genregulation außer Kontrolle? Diese Modelle beruhen unter anderem auf Sequenzierungsdaten – und können beispielsweise zeigen, wie sich Mikroorganismen im Darm mit Zellen des menschlichen Wirts austauschen und wie es zu Erkrankungen kommt.
In der Arbeitsgruppe von Altuna Akalin analysieren Forschende große Datensätze.
Dr. Sofia Forslund vergleicht solche Computersimulationen mit einer Kristallkugel. Der Blick in die Kugel verrät, in welche Richtung die Forschung zunächst weitergehen sollte: Tausende Faktoren können für eine Darmentzündung im Körper verantwortlich sein; ein Datenmodell schränkt die Auswahl möglicher Ursachen erheblich ein. „So können wir potenzielle Hypothesen eingrenzen“, sagt sie.
Unbekannte Einflüsse können niemals alle Teil eines Modells sein.
Allerdings wirken in der Realität auch Umweltfaktoren auf die Wirt-Mikrobiom-Interaktion ein und andersherum beeinflussen etwa soziale Kontakte der Proband*innen oder die Ernährung das Mikrobiom. „Solche unbekannten Einflüsse können niemals alle Teil eines Modells sein“, sagt Forslund.
Das Grundgerüst jedes mathematischen Modells sind Annahmen, die Forschende zuvor getroffen haben. „Am Anfang steht immer eine Hypothese. Wir müssen entscheiden, welche Prozesse wichtig und welche unwichtig sind für das Problem, das wir betrachten“, sagt Professor Martin Falcke, der physiologische Vorgänge in den Lebenswissenschaften modelliert. „Ob unsere anfänglichen Annahmen die richtigen sind, können wir nur in Tierversuchen überprüfen.“
Alternativen zum Tierversuch als ergänzendene Methoden
Jedes Forschungsmodell bleibt ein Abbild oder eine Möglichkeit der Realität – eine Vereinfachung der natürlichen Situation. Das gilt für simple Zellkulturen genauso wie für induzierte Stammzellen, die vermeintlichen Alleskönner unter den Zelllinien. Weder die komplexeren Organoide noch Simulationen am Computer können Tierversuche in der Forschung bislang komplett ersetzen. Und auch der Tierversuch ist nur eine Annäherung.
Die meisten Forschenden am MDC sprechen nicht von Alternativen zum Tierversuch – sondern von ergänzenden Methoden. Für sie steht fest: Untersuchungen in vitro und in silico können dabei helfen, im Sinne der 3R zu handeln und die Zahl der Tierversuche zu reduzieren – aber ein Ersatz sind sie noch nicht.
Text: Christina Anders